Fas 2b-studie i MTX-naiva RA-patienter med svår sjukdomsaktivitet (slutförd)
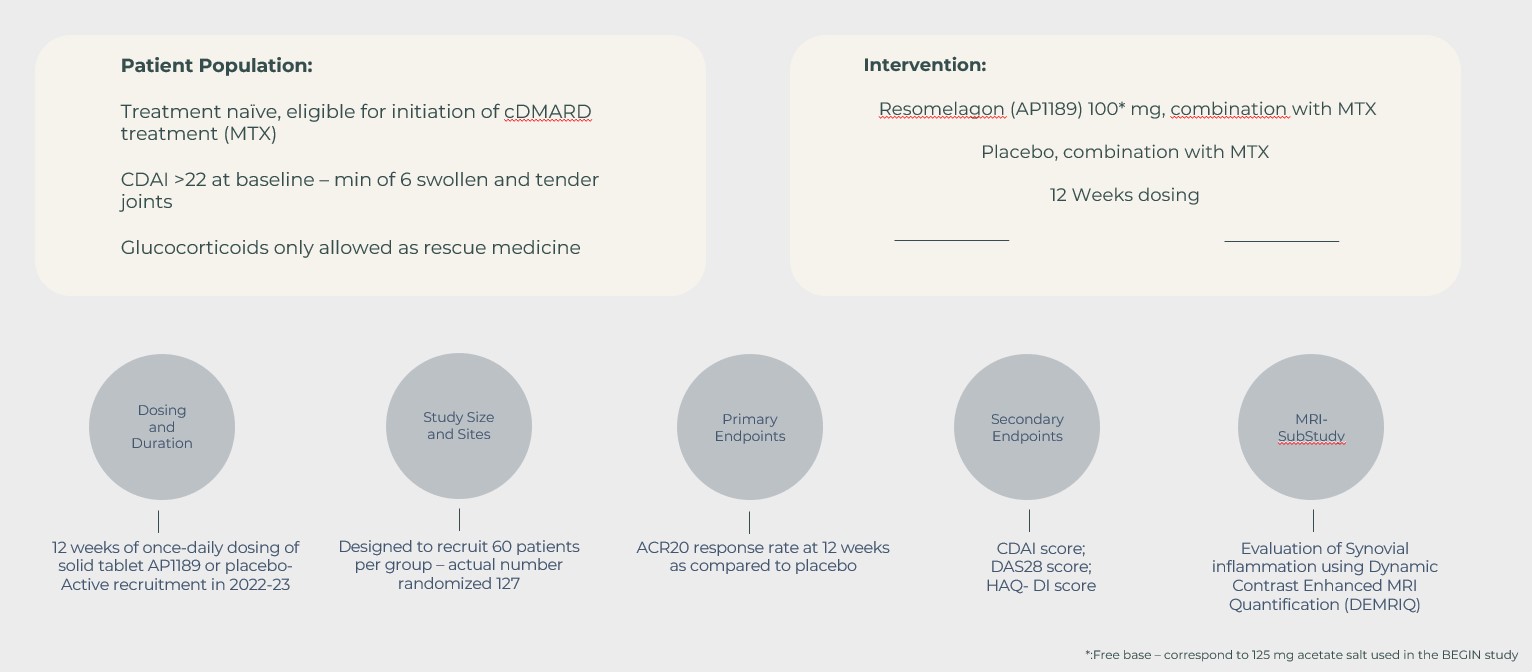
Som en fortsättning på BEGIN-studien designades EXPAND-studien för att undersöka säkerhet och sjukdomsaktivitet (mätt med ACR20-svarsfrekvens och andra mått på RA-sjukdomen) efter 12 veckors behandling med en 100 mg resomelagon-tablett en gång dagligen plus MTX, jämfört med placebo plus MTX.
Resomelagon var säkert och tolererades väl. Liknande incidensnivåer av behandlingsrelaterade biverkningar (TEAE) sågs i behandlingsgrupperna (44,4 % och 42,2 %). TEAE sågs hos 11,1 % respektive 6,3 % i resomelagon- respektive placebogrupperna och inkluderade övre luftvägsinfektioner (6,3 % vs 6,3 %), buksmärta i övre delen av buken (6,3 % vs 3,1 %), illamående (6,3 % vs 3,1 %) och huvudvärk (0 % vs 9,4 %), resomelagon respektive placebo. Två allvarliga TEAE rapporterades; en i resomelagon-gruppen och en i placebogruppen, men ingen var relaterad till studieläkemedlet. Sex försökspersoner rapporterade TEAE som ledde till utsättning; fem i resomelagon-gruppen (3 försökspersoner med läkemedelsrelaterade gastrointestinala störningar); och en i placebogruppen (ej relaterad till studieläkemedlet).
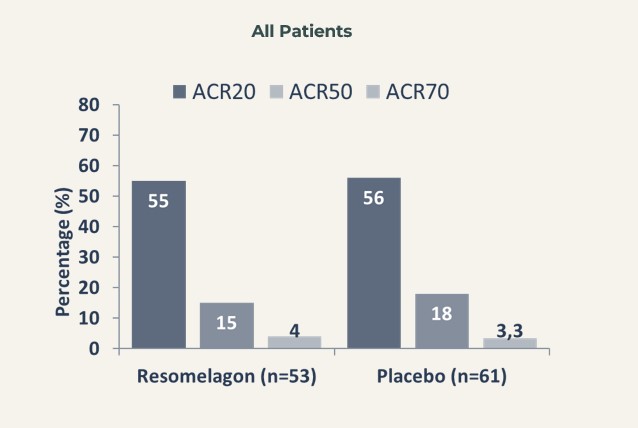
Ingen statistiskt signifikant skillnad erhölls mellan resomelagon och placebo i svarsfrekvensen för ACR20 vid vecka 12 (54,7 % och 55,7 % i resomelagon- respektive placebogruppen) – vilket innebär att studiens primära effektmått inte uppnåddes.
Av patientpopulationen i EXPAND-studien visade dock cirka 40 % inga tecken på systemisk inflammation, eftersom högkänsligt C-reaktivt protein (hsCRP) låg inom normalområdet (dvs hsCRP <3 mg/L). Dessutom ansågs en del av patienterna inte vara nydiagnostiserade, och vissa hade varit utan adekvat behandling i flera år innan de ingick i studien. Därför borde dessa patienter förmodligen inte ha ingått i studien.
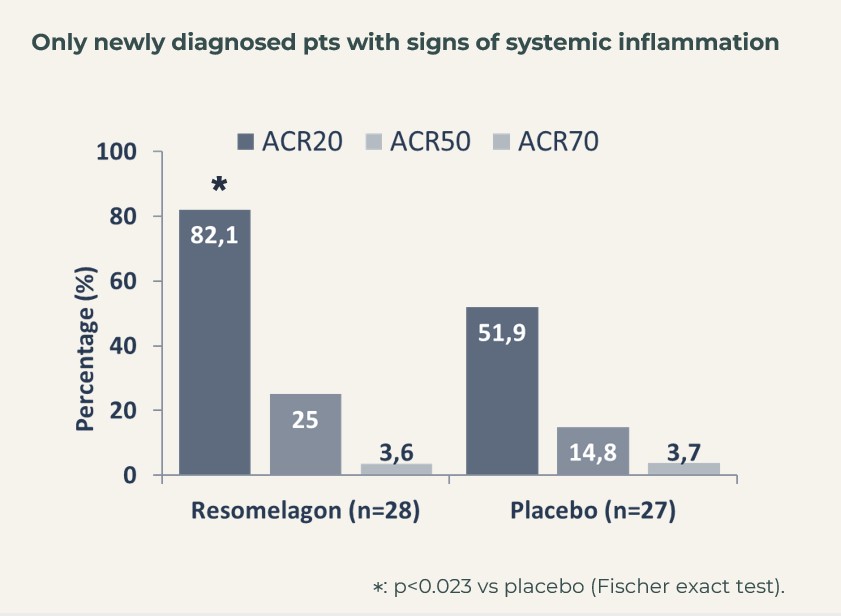
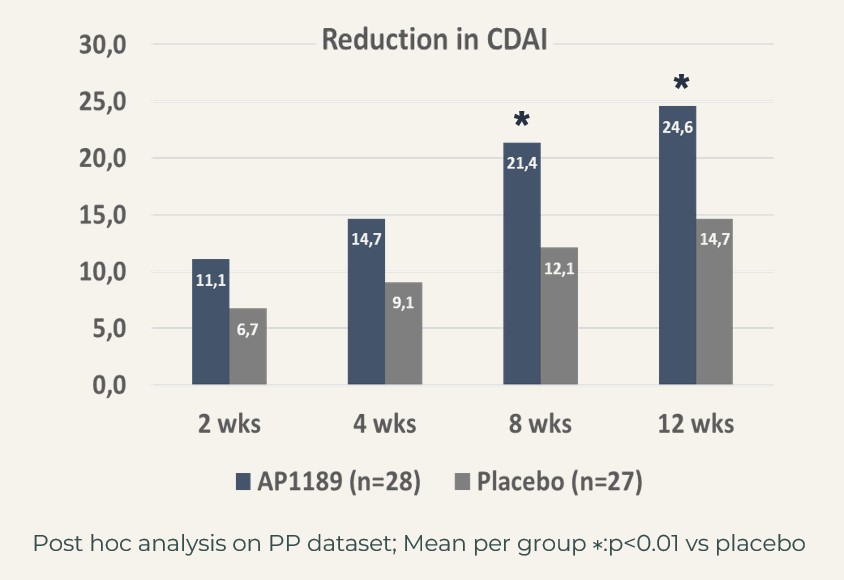
När man fokuserade på det segment av patienter som ansågs vara nydiagnostiserade (definierade som att de hade fått diagnosen RA inom 6 månader efter att de inkluderats i studien) och som visade tecken på systemisk inflammation (hsCRP>3 mg/L vid studiens början), nådde ACR20 82 % i resomelagon-gruppen (n=28) jämfört med 52 % i placebogruppen (n=27), p<0,05 med Fishers exact test.
Behandlingseffekten i detta mycket relevanta patientsegment, som efterliknar patienterna i BEGIN-studien, vilket alltså kan betraktas som målpopulationen för resomelagon vid RA, stöddes ytterligare av en signifikant större minskning av sjukdomsaktivitetsmått:
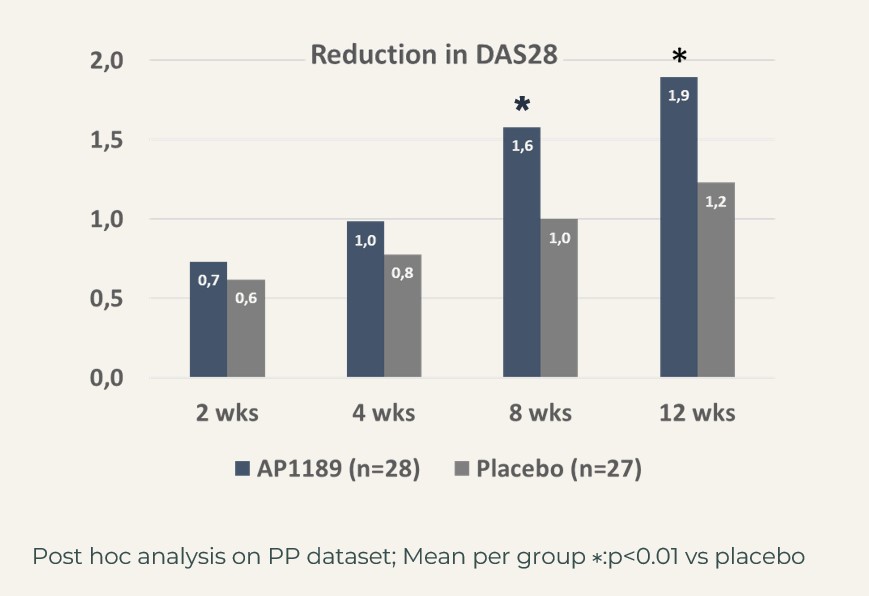
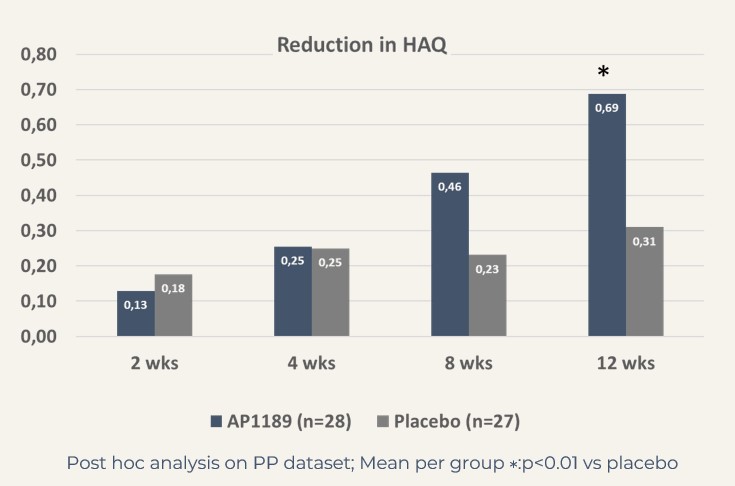
CDAI: resomelagon (n=28): 24,6 poäng jämfört med placebo (n=27): 14,7 poäng, p<0,01; DAS28-CRP: resomelagon (n=28): 1,9 poäng jämfört med placebo (n=27): 1,2 poäng, p<0,01. Förbättringen av hälsobedömningsformuläret HAQ, ett mått på patientens förmåga att hantera det dagliga livet, var också signifikant större i resomelagon-gruppen: förändring i HAQ: resomelagon (n=28): 0,69 poäng jämfört med placebo (n=27): 0,31 poäng, p<0,05.
Tillsammans ger dessa post hoc-analyser starkt stöd för fortsatt utveckling av resomelagon hos nydiagnostiserade RA-patienter med hög sjukdomsaktivitet inklusive tecken på systemisk inflammation som behandlas tillsammans med MTX.